¿Qué es la materia?
La materia es todo aquello que tiene masa por lo cual lo podemos percibir con nuestros sentidos, por lo tanto ocupa un, lugar en el espacio.Todo cuerpo está hecho compuesto de materia.
Fuentes: http://roble.pntic.mec.es/csoto/qesmater.htm
Clasificacion de la materia:
Materia homogénea: Es aquella que tiene una composición uniforme, en la cual no se pueden distinguir a simple vista.
La materia heterogénea es aquella cuyos componentes se distinguen unos de otros.
Fuente: Enciplopedia Tematica, editorial Exus.
Clases de materia:
-Materia Orgánica: La materia orgánica es toda aquella que tiene vida, como lo son los animales, plantas, el ser humano, etc.
-Materia Inorgánica: Es toda aquella que no tiene vida.
Fuente: libro de quimica
El atomo:
2.1. Definición de atomo:
El átomo, es la unidad mas pequeña posible de un elemento, el primero en utilizar este término fue Demócrito porque creía que todos lo elementos deberían estar formados por pequeñas partículas que fueran indivisibles. (Átomo en griego significa indivisible). Pero hoy en día sabemos que los átomos no son indivisibles sino que están formados por tres partículas o mas.
Fuente: http://es.wikipedia.org/wiki/Ãtomo
2.2 Descripción de las teorias atomicas y modelos atomicos.
Teoría atómica de Jhon Dalton (1766-1844)
Jhon Dalton planteó lo siguiente:
*Los elementos químicos están formados por partículas muy pequeñas e indivisibles llamadas átomos. * Todos los átomos de un elemento químico dado son idénticos en su masa y demás propiedades. *Los átomos de diferentes elementos químicos son distintos, en particular sus masas son diferentes. *Los átomos son indestructibles y retienen su identidad en los cambios químicos. *Los compuestos se forman cuando átomos de diferentes elementos se combinan entre sí, en una relación de números enteros sencilla, formando entidades definidas (hoy llamadas moléculas).
Fuente:
http://www.academica.ues.edu.sv/uiu/elementos_estudio/ciencias_naturales/quimica/quimica.pdf
Modelo atómico de J.J.Thompson (1856-1940)
Las hipótesis de J.J.Thompson fueron:
*La materia es eléctricamente neutral, a lo que hace pensar que, además de electrones, debe de haber partículas con carga positiva. *Los electrones pueden extraerse de los átomos, pero no así las cargas positivas. Según el modelo de J.J.Thompson el átomo era una esfera uniforme de materia de carga positivamente en la que se hallaban incrustados los electrones de un modo parecido a como lo están las semillas en una sandía.

Fuente:
http://www.academica.ues.edu.sv/uiu/elementos_estudio/ciencias_naturales/quimica/quimica.pdf
Modelo atómico de Rutherford(1871-1937)
Rutherford fue un famoso hombre que obtuvo el premio Nóbel de química en el año 1919.En 1911 realizó una experiencia que supuso un paso muy importante en el conocimiento del átomo. La experiencia de Rutherford consistió en bombardear con partículas alfa una finísima lámina de oro, Las partículas alfa atravesaban la lámina de oro y eran recogidas sobre una pantalla de sulfuro de cinc. La importancia del experimento estuvo en que mientras la mayoría de partículas atravesaban la lámina sin desviarse o siendo desviadas solamente en pequeños ángulos, unas cuantas partículas eran dispersadas a ángulos grandes hasta 180º Con la información que tenía de su experiencia Rutherford propuso en el año 1911 este modelo de átomo: *El átomo está constituido por una zona central , a la que se llama núcleo, en la que se encuentra toda la carga positiva y casi toda la mas del núcleo. *Hay otra zona exterior del átomo, la corteza, en la que se encuentra toda la carga negativa y cuya masa es muy pequeña en comparación con la del átomo. La corteza está formada por los electrones que tenga el átomo. *Los electrones se mueven a gran velocidad en torno al núcleo. *El tamaño de núcleo es muy pequeño en comparación con el del átomo(Unas 100.000 veces menor) “A pesar de construir un gran avance y de predecir hechos reales, el modelo nuclear de Rutherford presenta 2 graves inconvenientes”: *Contradecía las leyes electromagnéticas de Maxwell, según las cuales, una partícula cargada, cuando posee aceleración, emite energía electromagnética. *Según el enunciado anterior los espectros atómicos deberían de ser discontinuos, formados por líneas
 Fuente:
Fuente:
http://www.academica.ues.edu.sv/uiu/elementos_estudio/ciencias_naturales/quimica/quimica.pdf
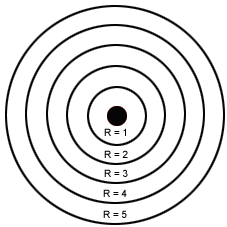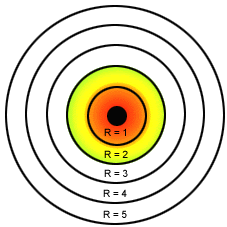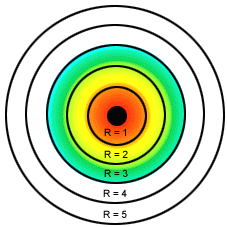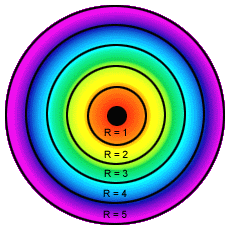
Modelo atómico de Bohr para el átomo de hidrógeno.
*La teoría de los cuantos de Planck le aporto a Bohr 2 ideas. Las oscilaciones eléctricas del átomo solo pueden poseer cantidades discretas de energía.Solo se emite radiacción cuando el oscilador pasa de un estado cuantizado a otro de mayor energía. *Bohr aplicó estas ideas al átomo de hidrógeno y enunció los tres postulados siguientes: *En el átomo de Hidrógeno el movimiento del electrón alrededor del núcleo esta restringido a un número discreto de orbitas circulares. *El momento angular del electrón en una orbita está cuantizado; es un numero entero de h/2pi, siendo h la constante de Planck. *El electrón no radia energía mientras permanece en una de las órbitas permitidas, teniendo en cada órbita una energía característica constante.Cuando el electrón cae de un estado de energía superior a otro de energia inferior, se emite una cantidad de energía definida en forma de un fotón de radiación. *Este modelo implicaba los siguientes postulados:
1.- El electrón tenía ciertos estados definidos estacionarios de movimiento (niveles de energía) que le eran permitidos; cada uno de estos estados estacionarios tenía una energía fija y definida.
2.- Cuando un electrón estaba en uno de estos estados no irradiaba pero cuando cambiaba de estado absorbía o desprendía energía.
3.- En cualquiera de estos estados, el electrón se movía siguiendo una órbita circular alrededor del núcleo.
4.- Los estados de movimiento electrónico permitidos eran aquellos en los cuales el momento angular del electrón (m.v.r) era un múltiplo entero de h/2.3.14
Fuente:
http://www.academica.ues.edu.sv/uiu/elementos_estudio/ciencias_naturales/quimica/quimica.pdf
Arnold Sommerfeld: propuso orbítales elípticas pero no pone formas de de absorción o emisión de energía del átomo.

Fuente:
http://www.academica.ues.edu.sv/uiu/elementos_estudio/ciencias_naturales/quimica/quimica.pdf
Estructura del átomo
En el átomo podemos encontrar 2 partes muy importantes:
El núcleo: Es la parte central del átomo y contiene partículas con carga positiva, los protones y partículas que no poseen carga eléctrica, es decir son neutras, los neutrones. Todos los átomos de un elemento químico tienen en el núcleo el mismo número de protones.
La Corteza: Es la parte exterior del átomo. En ella se encuentran los electrones, con carga negativa. La masa de un electrón es unas 2 mil veces menor que la de un protón.
Los átomos son Eléctricamente neutros, debido a que poseen igual cantidad de protones que de electrones. Así, el número atómico también coincide con el número de electrones.
La suma del número de protones y el número de neutrones de un átomo recibe el nombre de número másico y se representa con la letra A. Aunque todos los átomos de un mismo elemento se caracterizan por tener el mismo número atómico, pueden tener distinto número de neutrones.
Son bosones las partículas alfa, los fotones y los nucleidos con un número par de nucleones.
fuente:
Particulas subatomicas
Bosón: Partícula atómica o subatómica, de espin entero o nulo, que cumple los postulados de la estadística de Bose-Einstein e incumple el principio de exclusión de Pauli. Son bosones las partículas alfa, los fotones y los nucleidos con un número par de nucleones.
Comentario: son parituculas de espin entero o nulo. Los bosones son las particulas alfa, los fotones y los nucleidos con un número par de nucleones.
Positrón: Partícula elemental de masa y espín iguales a los del electrón y cuya carga eléctrica es también igual a la de éste pero de signo contrario (positiva). El positrón es un leptón que se considera como antipartícula del electrón. Prevista su existencia por Dirac (1930), Anderson consiguió detectarlo en los rayos cósmicos (1932). El positrón se crea por transformación de un fotón en un par electrón-positrón y, a pesar de su relativa estabilidad, se aniquila por interacción con los electrones.
Comentario: es una particula de masa igual a a la de un electron, tambien igual carga pero positiva. Es una antiparticula del electron.
Electrón: Tipo de partícula elemental que, junto con los protones y los neutrones, forma los átomos y las moléculas. Fue descubierto por J.J. Thomson. Los electrones intervienen en una gran variedad de fenómenos. El flujo de una corriente eléctrica en un conductor es causado por el movimiento de los electrones libres del conductor. La conducción del calor también se debe fundamentalmente a la actividad electrónica. En los tubos e vacío, un cátodo calentado emite una corriente de electrones que puede emplearse para amplificar o rectificar una corriente eléctrica. Si esa corriente se enfoca para formar un haz bien definido, éste se denomina haz de rayos catódicos. Si se dirigen los rayos catódicos hacia un objetivo adecuado, producen rayos X; si se dirigen hacia la pantalla fluorescente de un tubo de televisión y producen imágenes visibles.
Electron es una partcula de carga electrica negativa(-), fue descubrierto por Thompson es muy importante, se translada libremente por todo el atomo.
Protón: Partícula nuclear con carga positiva igual en magnitud a la carga negativa del electrón; junto con el neutrón, está presente en todos los núcleos atómicos. Al protón y al neutrón se les denomina también nucleones. El núcleo del átomo de hidrógeno está formado por un único protón. La masa de un protón es de 1,6726 × 10-27 kg, aproximadamente 1.836 veces la del electrón. Por tanto, la masa de un átomo está concentrada casi exclusivamente en su núcleo. El protón tiene un momento angular intrínseco, o espín, y por tanto un momento magnético. Por otra parte, el protón cumple el principio de exclusión. El número atómico de un elemento indica el número de protones de su núcleo.y determina de qué elemento se trata. En física nuclear, el protón se emplea como proyectil en grandes aceleradores para bombardear núcleos con el fin de producir partículas fundamentales. Como ion del hidrógeno, el protón desempeña un papel importante en la química.
Comentario: es una particula subatomica de carga electrica posistic, la cual se encuentra en el nucleo del atomo, la masa del atomo se encuentra en el nucleo con el neutron. en maginitudes es igual a la carga negativa(electron).
Fermión: Partícula perteneciente a una familia de partículas elementales caracterizada por su momento angular intrínseco o espín. Según la teoría cuántica, el momento angular de las partículas sólo puede adoptar determinados valores, que pueden ser múltiplos enteros de una determinada constante h (constante de Planck) o múltiplos semienteros de esa misma constante. Los fermiones, entre los que se encuentran los electrones, los protones y los neutrones tienen múltiplos semienteros de h, por ejemplo ±1/2h o ±3/2h. Los bosones, en cambio, como por ejemplo los mesones, tienen un espín que corresponde a un múltiplo entero de h, como 0 ó ±1. Los fermiones cumplen el principio de exclusión, al contrario que los bosones.
Comentario: Partícula perteneciente a una familia de partículas elementales caracterizada por su momento angular intrínseco o espín
Neutrino: Partícula nuclear elemental eléctricamente neutra y de masa muy inferior a la del electrón (posiblemente nula). El neutrino es un fermión; su espín es 1/2. Antes del descubrimiento del neutrino, parecía que en la emisión de electrones de la desintegración beta no se conservaban la energía, el momento y el espín totales del proceso. Para explicar esa incoherencia, el físico austriaco Wolfgang Pauli dedujo las propiedades del neutrino en 1931.
comentario: se cree que no tiene carga es decir es nulo.
Hadrón: Partícula subatómica compuesta de quarks, caracterizada por relacionarse mediante interacciones fuertes. Aunque pueden manifestar también interacciones débiles y electromagnéticas, en los hadrones predominan las interacciones fuertes, que son las que mantienen la cohesión interna en el núcleo atómico. Estas partículas presentan dos categorías: los bariones, formados por tres quarks, como el neutrón y el protón, y los mesones, formados por un quark y un antiquark, como el pión.
Comentario: particula compuesta por quark, se relacionan por medio de interracciones fuertes en la mayoria de casos. Pero veces se relacion por medio de relaciones deviles.
presentan dos categarias las cuales son: los barriones y los mesones.
Neutrón: Partícula sin carga que constituye una de las partículas fundamentales que componen la materia. La masa de un neutrón es de 1,675 × 10-27 Kg., aproximadamente un 0,125% mayor que la del protón. La existencia del neutrón fue profetizada en 1920 por el físico británico Ernesto Rutherford y por científicos australianos y estadounidenses, pero la verificación experimental de su existencia resultó difícil debido a que la carga eléctrica del neutrón es nula y la mayoría de los detectores de partículas sólo registran las partículas cargadas.
Comentario:es de carga electrica neutra mas bien dicho no tienen carga.
Leptón:
Existen tres tipos de leptones conocidos, relacionados, respectivamente, con los electrones, con los muones y con los neutrinos. Los leptones electrónicos comprenden el propio electrón, así como el neutrino asociado a éste y sus correspondientes antipartículas. Los leptones muónicos comprenden el muón (de masa cien veces superior al electrón), su neutrino asociado y las correspondientes anticpartículas. Finalmente, el leptón tau, con una masa del orden de los 1.800 MeV, es aún poco conocido.
Quark: Nombre genérico con que se designan los constituyentes elementales de los hadrones.La teoría sobre los quarks se inició a partir de los trabajos de Gell-Mann y Zweig (1966) y su existencia fue confirmada en 1977 (Fairbank y otros) con métodos semejantes a los empleados en la experiencia de Millikan.
La física dedicada al estudio de la naturaleza fundamental de la materia (física de las partículas elementales) ha formulado un modelo estándar, capaz de explicar una serie de hechos e incapaz de dar respuesta a otros. Este modelo se basa en la actualidad en la hipótesis de que la materia ordinaria está formada por dos clases de partículas, los quarks (que se combinan para formar partículas mayores, tales como el protón o el neutrón) y los leptones (que incluyen el electrón y su neutrino), además de que las fuerza que actúan entre ellas se transmiten mediante una tercera clase de partículas, conocida con el nombre de bosones.
Comentario: Nombre genérico con que se designan los constituyentes elementales de los hadrones. La teoría sobre los quarks se inició a partir de los trabajos de Gell-Mann y Zweig (1966) y su existencia fue confirmada en 1977 (Fairbank y otros) con métodos semejantes a los empleados en la experiencia de Millikan.
Mesón: Nombre que recibe cada una de las partículas elementales sometidas a interacciones fuertes, de espín nulo o entero y carga bariónica nula.
Los mesones, identificados por Powell en 1947 en los rayos cósmicos y cuya existencia había sido postulada por Yukawa en 1935, son partículas inestables, de masa generalmente comprendida entre la de los electrones y la de los neutrones.Los más estables, cuya vida media es del orden de la cienmillonésima de segundo, son los piones y los kaones.
Comentario: Nombre que recibe cada una de las partículas elementales sometidas a interacciones fuertes, de espín nulo o entero y carga bariónica nula.
Fuente: http://perso.wanadoo.es/chyryes/glosario/otraspar.htm
4. Definición y ejemplos de:
4.1 Elementos y ejemplos: Elemento químico hace referencia a una clase de átomos; todos ellos con el mismo número de protones en su núcleo. Aunque, por tradición, se puede definir elemento químico como aquella sustancia que no puede ser descompuesta, mediante una reacción química, en otras más simples.
Ejemplo:
Los elementos químicos de la tabla periódica.
Las plantas
Los animales
El ser humano
4.2 Mesclas y ejemplos:
Es un material formado por dos o más sustancias en proporciones variables que conservan sus propiedades; las sustancias intervienen en cantidades variables; sus componentes pueden separarse por medios físicos (destilación, evaporación, cristalización, etc.), generalmente no hay absorción o desprendimiento de energía al hacerlo (interacción química); las sustancias no están químicamente combinadas, es decir, no se forman nuevas sustancias. Las disoluciones son aquellas en las que sus componentes se encuentran distribuidos uniformemente.
Ejemplos:
El basalto
La arena
El cemento
Clases:
Mezcla homogénea: (llamadas también soluciones), tienen apariencia uniforme y solo se ven como una sola fase. Presentan iguales propiedades en todos sus puntos. Se separan por cristalización, extracción, destilación y cromatografía. Estas mezclas se conocen más genéricamente como soluciones. Una solución está constituida por un “solvente”, que es el componente que se halla en mayor cantidad o proporción y uno o más “solutos”, que son las sustancias que se hallan dispersas homogéneamente en el solvente. El solvente universal es el agua, puede estar a una proporción de 40/60 y el agua continua siendo el solvente en esa mezcla. Las partículas del soluto son tan pequeñas (moléculas, átomos o iones) que no se pueden ver ni siquiera con un ultramicroscopio. El tamaño de estas partículas es aproximadamente la cienmillonésima parte de un centímetro. Por esto no se sedimentan y, además, atraviesan un papel filtro.
Mezcla Heterogénea: Presentan un aspecto no uniforme. Se separan por filtración, decantación y por separación magnética. Están formadas por dos o más sustancias puras que se combinan, conservando cada una sus propiedades particulares, de tal manera que podemos distinguir las sustancias que la componen.
4.4 Solucion y ejemplos:
Solución: Una solución es una mezcla homogénea de dos o mas sustancias. La sustancia disuelta se denomina soluto y esta presente generalmente en pequeña cantidad en pequeña cantidad en comparación con la sustancia donde se disuelve denominada solvente. en cualquier discusión de soluciones, el primer requisito consiste en poder especificar sus composiciones, esto es, las cantidades relativas de los diversos componentes.
Clasificación:
PÒR SU ESTADO DE:
-SÓLIDAS
-LIQUIDAS
-GASEOSAS
POR SU CONCENTRACION:
-SOLUCION NO-SATURADA; es aquella en donde la fase dispersa y la dispersante no están en equilibrio a una temperatura dada; es decir, ellas pueden admitir más soluto hasta alcanzar su grado de saturación.Ej: a 0 ºC 100 g de agua disuelven 37,5 NaCl, es decir, a la temperatura dada, una disolución que contengan 20g NaCl en 100g de agua, es no saturada.
-SOLUCION SATURADA: en estas disoluciones hay un equilibrio entre la fase dispersa y el medio dispersante, ya que a la temperatura que se tome en consideración, el solvente no es capaz de disolver más soluto. Ej una disolución acuosa saturada de NaCl es aquella que contiene 37,5 disueltos en 100 g de agua 0 ºC.-SOLUCION SOBRE SATURADA: representan un tipo de disolución inestable, ya que presenta disuelto más soluto que el permitido para la temperatura dada.Para preparar este tipo de disoluciones se agrega soluto en exceso, a elevada temperatura y luego se enfría el sistema lentamente. Estas soluciones son inestables, ya que al añadir un cristal muy pequeño del soluto, el exceso existente precipita; de igual manera sucede con un cambio brusco de temperatura.
5. ciclos biogeoquimicos
5.1 concepto
Una molécula necesaria para la vida de un organismo, se llama nutrimento o nutriente. Los organismos vivos necesitan de 30 a 40 elementos químicos, donde el número y tipos de estos elementos varía en cada especie.
Los elementos requeridos por los organismos en grandes cantidades se denominan macronutrientes: carbono, oxígeno, hidrógeno, nitrógeno, fósforo, azufre, calcio, magnesio y potasio. Estos elementos y sus compuestos constituyen el 97% de la masa del cuerpo humano, y más de 95% de la masa de todos los organismos. Los 30 ó más elementos requeridos en cantidades pequeñas (hasta trazas), se llaman micronutrientes: hierro, cobre, zinc, cloro, yodo.En los ciclos biogeoquímicos se pueden reconocer dos partes o compartimientos: la biótica y la abiótica.
5.2 descripcion de cada uno
Hay tres tipos de ciclos biogeoquímicos interconectados:
-Gaseoso
-Sedimentario
-Hidrológico
En el ciclo gaseoso, los nutrientes circulan principalmente entre la atmósfera y los organismos vivos. En la mayoría de estos ciclos los elementos son reciclados rápidamente, con frecuencia en horas o días. Los principales ciclos gaseosos son los del carbono, oxígeno y nitrógeno.
En el ciclo sedimentario, los nutrientes circulan entre la corteza terrestre (suelo, rocas y sedimentos), la hidrosfera y los organismos vivos. Los elementos en este ciclo, generalmente reciclan mucho más lentamente que en el ciclo atmosférico, porque los elementos son retenidos en las rocas sedimentarias durante largo tiempo geológico (hasta de decenas a miles de milenios y no tienen una fase gaseosa).
En el ciclo hidrológico, el agua circula entre el océano, el aire, la tierra y la biota, este ciclo también distribuye el calor solar sobre la superficie del planeta.
5.3 infuencias de preoduccion de alimentos
· La parte biótica: Comprende la inclusión de sustancias inorgánicas en el organismo y la subsiguiente descomposición y remineralización. El intercambio de elementos es rápido, pero la cantidad de sustancias inorgánicas no es mayor. El organismo vivo toma elementos inorgánicos y al morir y descomponerse éstos son devueltos al ambiente para ser nuevamente aprovechados.· La parte abiótica: El medio contiene gran cantidad de sustancias inorgánicas, que se descomponen con lentitud y están a disposición del organismo en forma abundante y fácil (agua, dióxido de carbono, oxigeno) o escasa y difícil (fósforo y nitrógeno, por ejemplo). En el primer caso se trata de ciclos atmosféricos con grandes reservas de materiales; en el segundo se trata de materiales sedimentarlos (fósforo, hierro, azufre, magnesio, y elementos menores).
6. organizacion de los elementos quimicos
6.1 historia
Döbereiner: el químico Döbereiner en 1817 dijo que había similitudes entre los elementos agripados en triadas. La triada del Cloro, del Bromo y del Yodo es un ejemplo. Pone en evidencia que la masa de unos de los tres elementos de una triada es intermedia entre los otros dos. En 1850 ya contava con 20 triadas para llegar a un primera clasificacion.
Chancourtois y Newlands: en 1864 un químico ingles llamado Chancourtois y Newlands anuncio la ley de las octavas, la cual decía que la propiedad generales se repitan cada ocho elementos. Pero esta ley no se puede aplicarse despues del calcio. Esta clasificación es por lo tanto suficiente.
Meyer: clasifica a la tabla periódica según su volumen atómico similar en relación de otros elementos.
Mendeleïev: 1869 un químico ruso llamado Mendeleïev presento la primera versión de la tabla periódica, la cual estaba clasificada estaba en relación de sus masas atómicas. La primera tabla poseía 63 elementos.
La agrupo en agrupaciones horizontales la cuales se le llamo con el nombre de familia.
Para hacer esta clasificación tuvo que dejar unos despaciosos en blanco, estos espacios en blanco eran elementos químicos a un no descubiertos pero dejo diciendo sus propiedades generales, al pasar de los años se descubrieron y las propiedades generales eran la había dicho Mendeleïev.
La tabla de Mendeleïev tuvo unos siervos por la determinación de la masa atómica de esa época.
Tabla periódica moderna: en la tabla periódica moderna hay 18 grupos o familias, la distribución de los elementos químicos es porque los elementos de un mismo grupo poseen la misma configuración electrónica en su capa más externa por eso tiene los elementos de un mismo grupo tienen propiedades físicas y químicas similares.
Comentarios:
http://www.lenntech.com/espanol/tabla-peiodica/historia-de-la-tabla-periódica.htm
5.2 descripcion de la tabla periodica.
1.- Grupo I A
Los elementos del grupo IA se caracterizan por tener un solo electrón en un orbital s situado fuera de la estructura de un gas noble. IA perdida de este electrón ocasiona el estado de oxidación característico +1 para el grupo. Puesto que el electrón único esta débilmente unido, se pierde con facilidad y los metales alcalinos se oxidan con rapidez, como se puede ver por sus potenciales de reducción altamente negativos y sus bajas energías de iotización que aparecen en la tabla 18.1.
2. Grupo II A
Los elementos del grupo IIA tienen cada uno de ellos un orbital s como si fuera la estructura de un gas noble. Cuando reaccionan, siempre pierden estos dos electrones produciendo un estado de oxidación de +2 (por ejemplo, mg2+, ca2+). en general, los lamentos del grupo IIA se oxidan con facilidad y se ve que los potenciales de reducción de los alcalinotérreos son todos altamente negativos (tabla 18.2), aunque casi siempre son mas positivos que los de sus vecinos en el grupo IIA. esto es un reflejo del hecho que, dentro de un periodo especifico, los metales alcalinotérreos tienen mayores energías de iotización que los metales alcalinos y, en consecuencia, pierden sus electrones con mayor dificultad.
3. Grupo III A
En el grupo IIIA se empieza a ver por primera vez, mas de un estado de oxidación estable, al menos entre los elementos mas pesados. si bien el aluminio muestra solamente un estado de oxidación +3, que corresponde a la perdida de sus tres electrones exteriores, el galio, el indio y el talio existen tanto en un estado +1 (por la perdida del único electrón p del nivel exterior) como un estado +3 (el cual surge, como con el al, por la perdida de los tres electrones de valencia).
4. Grupo IV A
En el grupo vivase tiene solamente dos elementos que se pueden clasificar como verdaderos metales, el Sn y el Pb. sus configuraciones electrónicas externas corresponden a s2p2 y se encuentran dos estados de oxidación +2 y +4. Como en el grupo IV A, la estabilidad relativa del estado +2 aumenta al ir hacia abajo dentro del grupo. Por lo tanto, las soluciones de sn2+ son agentes reductores moderados debido a la relativa facilidad con que el sn se oxida al estado +4. en contraste, el pb2+ en medio acuoso, no tiene especial tendencia a oxidarse al estado +4. De hecho, los compuestos de Pbiv tienden a ser bastante buenos agentes oxidantes en soluciones acidas, denotando de este mod. Una fuerte tendencia del pbiv a convertirse en el Pbii, que es mas estable; esto se aplica al acumulador de plomo, en donde el pbo2 sirve como cátodo, mientras que el Pb sirve como ánodo. en el electrolito del acido sulfúrico, la reacción total de celda es
5. Grupo V
En este grupo solamente se encuentra un metal verdadero, el bismuto. Este tiene una configuración externa de 6s26p3 y, como los elementos de la parte inferior de los dos grupos anteriores, también forma compuestos en dos estados de oxidación. Estos presentan un estado de +3, por la perdida de tres electrones p, y un estado +5 que corresponde a la perdida (la menos en principio) de los cinco electrones de valencia. de hecho, no existe el Ion bi5+ y si se asigna un estado de oxidación +5 al Bi, realmente es el resultado de las reglas que se emplearon para calcular los números de oxidación.
6. Grupo VI A
En la tabla 31-1 se encuentran las estructuras electrónicas de los átomos de este grupo. Los seis electrones característicos del nivel quántico de valencia permiten predecir los números de oxidación: -2, +4 y +6. Como era de esperar, las afinidades electrónicas de estos átomos que se conocen son menores que las de los correspondientes halógenos.
7. Grupo VII A
El grupo VII A esta constituido por los halógenos o elementos formadores de sales: fluor, cloro, bromo, yodo y astuto. En conjunto, estos no metales tienen la electronegatividad media mas alta de la tabla periódica. no obstante, puesto que la electronegatividad disminuye al aumentar el peso atómico, es de esperar que algún halógeno tenga menor electronegatividad que un elemento del grupo VIa situado en un periodo mas elevado en la tabla periódica. Así, aunque el fluor, primer elemento de su grupo, es el mas electronegativo del sistema periódico (4,0); el oxigeno, primer elemento del grupo VI (3,5) es mas electronegativo que el clor (3,0). el cloro es el elemento mas abundante e importante de este grupo, por ello se dedica la mayor parte al estudio de sus propiedades como halógeno típico. Para evitar repeticiones, simplemente se indicaran las diferencias de los otros halógenos con el cloro. Pero es conveniente tener en cuenta que aunque se mencionen únicamente las diferencias, las semejanzas en el comportamiento son bastante importantes.
6.3 Elementos quimicos que hay en Piura: en espado de reserva, explotación, exportación.
Los elementos que hay en Piura en reserva son los siguiente:
-BentonitaArcillaSal común
-Caliza
-Mármol
-Arcilla refractaria
-Sal común
-Salmuera (liquido)
-Conchuelas
-Roca fosfórica (moral)
-Sal común
-Yeso
-Sílice
-Roca fosfórica (moral)
-Salmuera (liquido)
Fuente: http://frank-14-forever.blogspot.com/2007/03/trabajo-de-qumica.html
7. Propone y comparte medidas de presentación para cuidar la salud, alimentos.



